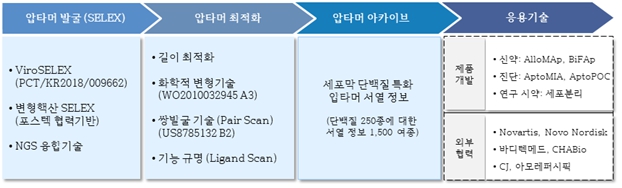
압타머사이언스는 압타머 기술 플랫폼 (Aptamer Technology Platform)을 기반으로 단백질이나 유전자소재로는 개발이 어려운 혁신적인 치료제 및 진단제품 개발을 통해 국민 삶의 질 향상 나아가 국가 의료비 절약에 기여한다는 비전으로 2011년 4월에 포항공대에서 spin-off 한 연구개발 기반 바이오기업으로 압타머 분야의 글로벌 선도기업입니다.
압타머사이언스의 압타머 기술 플랫폼은 고성능 압타머를 효과적으로 발굴하는 기술과 발굴된 압타머를 응용목적에 맞게 최적화하는 기술, 그리고 이에 기반한 혁신적인 치료제 및 진단제품 개발 기술에 이르기까지 완성도가 매우 높습니다.
압타머사이언스가 보유하고 있는 치료제 개발 시스템은 후보물질 발굴기간을 2~3년으로 단축시킨 획기적인 시스템입니다. 현재 AlloMAp과 BiFAp 2개의 플랫폼을 기반으로 당뇨 등 대사질환과 암질환 분야에서 first-in-class 치료제를 개발하고 있으며, 발굴된 치료제의 임상적 유효성 (Proof of Concept)을 확보한 후에 글로벌 제약사에게 라이센싱하거나 regional player와 공동개발을 추진하여 수익을 창출하는 사업모델입니다.
AlloMAp 플랫폼으로부터 발굴된 혁신 당뇨 치료제는 6개 글로벌 제약사와 비밀 유지 계약을 체결하는 등 높은 관심을 받았고, 당뇨 분야 세계 1위 기업인 Novo Nordisk사와는 물질 이전 계약을 통한 약효평가 과정을 성공적으로 마치고 후속 단계 협력을 논의 중에 있습니다. BiFAp 플랫폼에서 개발된 간암 치료제의 전임상 개발이 진행 중에 있고, 뇌질환에 적용할 BBB 셔틀 압타머 기술도 다수의 국내외 회사와 공동개발 및 라이센싱을 논의 중에 있습니다.
진단사업 영역에서는 AptoMIA 플랫폼을 기반으로 폐암 등 다양한 질병을 대상으로 조기진단 제품을 개발하고 있고 항체 기술이나 PCR 기술과는 차별화된 신속진단 기술 개발이 가능한 AptoPOC 플랫폼을 운영하고 있습니다. 세계 최초로 압타머 기반 진단 제품 상용화에 성공한 폐암 조기진단 키트는 혈액에 존재하는 복수의 단백질 바이오마커를 높은 민감도와 특이도로 검출하는 기술로 다기관 임상시험을 통하여 진단의료시장의 미충족 수요를충족시킬 수 있음을 입증하였습니다. 2017년 9월 한국식품의약품안전처 (MFDS)로부터 폐암 조기진단 키트에 대해 3등급 체외진단 의료기기 허가를 받았고, 이어서 CE 인증을 획득하였습니다. 현재 이원의료재단과 전략적 제휴계약을 체결하여 제품을 공급하고 있으며, 이원의료재단 영업부와 함께 검사영업을 진행하고 있습니다. 중국 및 싱가포르 등 해외 시장에서도 총괄 대리점 계약을 체결하고 현지 임상 및 판매허가를 획득하기 위한 절차를 진행 중에 있습니다.
압타머사이언스 2020년 배당금은 없습니다.

용어설명
| 압타머 (Aptamer) |
압타머는 3차원적 형태를 이루어 표적 물질에 특이적으로 결합하는 단일 가닥 올리고 핵산 물질이며 표적의 3차원적인 형태를 인식해 결합하는 특징을 가짐. 또한 생물학적 생산이 아닌 화학적 합성으로 생산하기 때문에 배치 재현성이 높고, 물질 안정성 (stability)도 우수하며, 제조가격도 저렴하고, 생체 내 면역원성 (immunogenicity)도 보고된 바가 없는 안전성도 우수한 바이오 소재 |
| 압타머 발굴 (SELEX) |
SELEX란 Systematic Evolution of Ligands by EXponential enrichment의 약자로, 다양한 핵산 라이브러리와 표적 분자와의 반복적인 결합 후 결합하지않은 핵산 라이브러리를 제거하고 표적 분자에 특이적으로 결합하는 것들만 선택적으로 선별하여 매우 우수한 결합력과 특이성을 보이는 압타머를 발굴할 수 있는 기술 |
| 압타머 합성 (Aptamer synthesis) |
압타머는 항체와 달리 화학적 합성으로 생체 외에서 생산하며, 다양한 화학적 변형 등이 용이. 또한, 높은 생산 재현성 (Low lot-to-lot variation)과 품질 관리가 가능하여 낮은 생산단가로 생산 가능 |
| 중합효소연쇄반응 (PCR) |
DNA (데옥시리보 핵산)를 증폭시키는 기술로, 일반 분석기기로 감지할 수 없는 극미량의 DNA 조각을 증폭하거나 압타머 발굴에서 표적 분자에 특이적으로 결합하는 핵산 라이브러리를 증폭할 때 사용 |
| 표적 분자 (Target molecule) |
단백질, 저분자 화합물, 탄수화물, 그리고 독소 등이 대표적인 표적 분자로서 진단 제품 또는 치료제 개발 시 표적 바이오마커가 표적 분자에 해당 |
| 변형핵산 (Modified nucleoside) |
핵산 서열의 특정 염기 (base)에 소수성 분자 (hydrophobic moiety)를 도입하여 핵산 라이브러리의 다양성 및 소수성을 증가시키고, 이로 인해 표적 분자내 소수성 부분과의 결합이 획기적으로 개선된 압타머를 높은 성공률로 발굴할 수 있는 기반 물질 |
| 해리상수 (Dissociation constant, Kd) |
압타머 성능을 확인하기 위한 척도로서 압타머가 표적 분자와 얼마나 강하게 결합하는지를 확인할 수 있는 지표로 값이 낮을수록 높은 결합력을 의미 |
| 플랫폼 기술 (Platform technology) |
진단제 및 치료제 개발에 있어 우수한 압타머를 발굴하고 제품화를 위한 핵심 분석, 기반기술을 의미. 다양한 질환 분야에 적용할 수 있으며, 지속적인기술개발을 통해 높은 부가가치를 창출하는 기술 |
| 알로스테리 결합 (Allosteric binding) |
세포막 수용체 상의 기존 리간드 결합 위치가 아닌 다른 위치에 결합하여 수용체의 활성을 조절하는 결합 방식 |
| 인슐린 민감제 (Insulin sensitizer) |
세포막 인슐린 수용체에 결합하여 자체적으로는 활성이 없으나 수용체의 인슐린 민감성을 증진하는 물질 |
| 표적 외 작용에 따른 부작용 (Off-target side effect) |
약물이 체내의 특정 표적 이외에 다른 곳에 비특이적으로 작용하여 나타나는 부작용 |
| 작용기전 (MOA, Mode Of Action) |
약물이 유효성을 나타내는 분자생물학 및 생화학적, 세포생물학적 작용 메커니즘 |
| 아고니스트 (Agonist) |
생체작용물질의 수용체에 결합하여 그 물질과 같은 또는 유사한 작용을 하는 물질 |
| 민감제 (Sensitizer) |
자신의 활성과 관계없이 내재적 인자/호르몬의 활성을 도와 효능을 향상 시키는 물질 |
| 인슐린 저항성 (Insulin resistance) |
세포가 체내에서 정상적으로 분비되는 인슐린에 반응하지 못하는 병리학적 상태 |
| 비밀 유지 계약서 (CDA, Confidential Disclosure Agreement) |
이해 당사자 간 체결되는 비밀유지계약으로 제 3자에게 이해 당사자의 비밀을 노출하지 않겠다는 내용의 약정 |
| 물질 이전 계약서 (MTA, Material Transfer Agreement) |
이해 당사자 간 체결되는 물질 이전 계약으로 해당 물질에 대한 검증을 목적으로 체결되는 계약 |
| 미충족 의학적 수요 (Unmet medical needs) |
치료가 필요한 환자 및 증상은 존재하지만 해당하는 적합한 치료법이 개발되지 못한 영역 |
| 전임상 단계 (Pre-clinical) |
의약품 개발 과정 중 새롭게 개발한 약물 후보물질을 사람에게 사용하기 전에 동물에게 적용하여 부작용이나 독성, 효과 등을 알아보는 시험단계 |
| 당화혈색소 (HbA1c) |
적혈구에 포함된 혈색소가 포도당과 결합하여 생성되며, 높은 혈중 포도당 상태에 혈색소가 장기간 노출되면 증가하여 당뇨병의 진단기준으로 활용됨 |
| 1형 당뇨 (Type 1 diabetes) |
인슐린 의존형 당뇨병으로 췌장 베타세포의 파괴로 인해 정상적인 인슐린 분비가 되지 않는 당뇨병 |
| 2형 당뇨 (Type 2 diabetes) |
인슐린 비의존형 당뇨병으로 인슐린은 정상적으로 분비되지만, 세포가 인슐린에 적절하게 반응하지 못하거나 병의 진행에 따라 인슐린이 부족하여 발생하는 당뇨병 |
| 최소 유효 용량 (MED, Minimum Effective Dose) | 약물이 효능을 나타내기 위한 최소의 용량 |
| 최대 내성 용량 (MTD, Maximum Tolerated Dose) | 약물이 독성을 나타내지 않는 최대의 용량 |
| 약물동태학 (PK, Pharmacokinetics) |
체내에 투여된 약물에 대해 인체가 그 약물에 어떤 영향을 어떻게 미치는지 흡수, 대사, 배설로 변하는 수치적 해석 |
| 약물동역학 (PD,Pharmacodynamics) |
체내에 투여된 약물에 의해 인체가 받는 영향으로 약물의 용량과 생체 반응 관계를 생리적, 생화학적 작용과 효과면에서 해석 |
| 비임상시험관리기준 (GLP, Good Laboratory Practice) | 의약품, 화학품 등의 안전성 평가를 위하여 실시하는 각종 독성시험의 신뢰성을 보증하기 위하여 연구인력, 시험시설, 장비, 시험 방법 등 시험의 전 과정에 관련된 모든 사항을 조직적, 체계적으로 관리하는 규정 |
| 화학, 제조 및 품질관리 (CMC, Chemistry, Manufacturing and Controls) | 의약품 개발과정에서 의약품의 품질과 연관된 연구개발 및 제조공정이 일관성 있게 조절 및 관리되고 있음을 문서화 하여 입증하는 것 |
| 최신 우수 의약품 제조 품질관리 기준 (cGMP, current good manufacturing practice) |
FDA (미국 식품의약국) 가 만든 가장 높은 수준의 GMP로서 의약품 제조를 위해 공장에서 원료의 구매부터 제조, 출하 등에 이르는 모든 과정에 필요한 관리 기준을 규정한 것 |
| 이종 이식 모델 (Xenograft model) | 인간의 세포/암 등에 대한 효능, 영향을 평가하기 위해 인간의 세포/암등을 동물에 이식해 제작한 모델 |
| 미국 식품의약국 (FDA, U.S. Food and Drug Administration) |
미국의 식품과 의약품에 대한 관리 규제를 하는 기관 |
| 유럽 의약품기구 (EMA, European Medicines Agency) |
유럽 의약품의 평가 및 감독을 하는 유럽 연합의 기관 |
| 정맥 주사 (IV injection, Intravenous injection) |
정맥에 주사하는 기법 |
| 피하 주사 (SC injection, Subcutaneous injection) |
피하 지방에 주사하는 기법 |
| 혈액-뇌 장벽 (BBB, Blood-Brain Barrier) | 뇌외 혈액을 격리시키는 혈관 장벽으로 뇌 모세혈관 내피 세포의 밀착연접 (tight junction)을 형성하여 고분자와 친수성 물질의 통과를 방해 |
| 체외진단검사 (IVD, In Vitro Diagnostics) |
질병 진단 및 예후, 건강 상태 판정, 질병 치료 효과 등의 목적으로 혈액, 체액, 조직 등 인체에서 유래한 물질을 이용해 신체 밖에서 진단하는 검사 |
| 체외진단 다지표 검사 (IVDMIA, In Vitro Diagnostic Multivariate Index Assay) |
환자의 질병이나 상태를 진단하거나 질병의 치료, 완화, 처치, 예방, 예후, 예측을 위하여 해석 함수를 사용하는 다지표 진단 방법. 해석 함수는 다양한 지표 (수치)들을 결합하여 환자 특이적인 결과 (위험군 분류, 점수, 인덱스 등)를 도출 |
| 현장 검사 (POC, Point-Of-Care) |
피검자 및 환자와 가까운 위치에서 원심분리 등 샘플 사전가공을 거치지 않고, 신속하게 시행해 진료 및 치료에 활용할 수 있는 임상병리 검사방식 또는 키트 |
| 바이오마커 (Biomarker) |
몸속 세포나 혈관, 단백질, DNA 등을 이용해 몸 안의 변화를 알아낼 수 있는 지표 |
| 임상적 검증 (Clinical validation) |
민감도, 특이도 등의 정보에 따라 진단 성능을 정확하게 예측하기 위한 검증 |
| 임상적 유효성 (Clinical efficacy) |
체외진단 다지표 검사 (IVDMIA)를 이용하여 바이오마커에 대해 수행한 시험이 환자의 질병 상태에 대한 판단 근거를 제공할 수 있는 성능 |
| 임상적 민감도 (Clinical sensitivity) |
특정 질환을 가지고 있는 사람 중 검사 결과가 양성으로 나오는 비율 |
| 임상적 특이도 (Clinical specificity) |
특정 질환을 가지고 있지 않은 사람 중 검사 결과가 음성으로 나오는 비율 |
| 위양성 (FP, False Positive) |
질병이나 증상이 없는 음성 환자나 음성 검사대상물에서 양성으로 나온 검사 결과 |
| 위음성 (FN, False Negative) |
질병이나 증상이 있는 양성 환자나 양성 검사대상물에서 음성으로 나온 검사 결과 |
| 선별검사 (Screening test) |
해당 질환의 고위험군을 조기에 발견하여 추가적인 관찰이나 직접적 예방 활동을 하기 위한 검사 |
| 예후 (Prognosis) |
환자의 상태나 질병의 결과에 대한 예측 |
| 조기진단 (Early diagnosis) |
특정 질환으로 확인되지 않은 사람을 대상으로 질환에 걸렸는지 또는 위험성이 있는지 미리 진단하여 어떤 검사 또는 치료법을 사용할 것인지 결정하기 위한 목적의 진단 |
| 모니터링 (Monitoring) |
수술 이후나 항암치료 후에 재발이 일어났는지, 치료 효과가 있는지를 추적하는 진단 |
| 비침습적 진단 (Non-invasive diagnosis) |
사람의 몸속으로 침투하지 않고 몸 밖으로 흘러나오는 또는 몸 밖에서 채취가 가능한 혈액, 가래, 대변 및 소변 등의 체액을 이용한 진단 행위 |
| 신의료기술 | 신의료기술평가사업본부 (NECA) 평가 결과 안전성 및 유효성이 인정된 진료행위로 건강보험심사평가원에서 급여/비급여로 결정되지 않은 의료기술 |
| 체외진단 의료기기 선진입 후평가 제도 |
식약처 의료기기 허가를 취득한 이후 건강보험 등재 절차로 바로 진입할 수 있도록 개선하고, 1~5년 판매후 신의료기술평가를 시행하는 제도로 2019년 4월 감염병 체외진단검사에 대해 시범사업이 진행되고 있으며, 2021년 체외진단 검사로 확대될 예정임. |
| 실험실개발테스트 (LDT, Laboratory Developed Test) |
임상 검사실에서 자체적으로 개발한 체외진단검사를 환자들에게 제공할 수 있도록 하는 제도 |
| 독립진단실험실 (ICL, Independent Clinical Laboratory) |
실험실개발테스트와 같은 개념으로 중국을 비롯한 동남아시아에서 환자들에게 제공할 수 있도록 하는 제도 |
포항공대에 구축된 압타머 발굴 기술 플랫폼에 기술적 기반을 두고 설립되었습니다. 포항공대는 우수한 바이오 기초 연구력을 활용하여 압타머 전담 연구조직을 운영하기로 하고 2006년 포항공대 생명공학연구센터에 압타머 사업단을 설립하였습니다.
압타머 사업단은 압타머 기술의 선도회사인 미국의 SomaLogic사와 협력하고 포항공대 교수 연구실들과 유기적으로 협력하여 압타머 발굴 기술 플랫폼 구축에 착수하였고, 압타머 발굴 및 응용제품 개발에 필요한 기술적 기반을 성공적으로 구축하였습니다.
2011년 4월 압타머 사업단 설립과 운영을 주도했던 포항공대 류성호 교수, 장승기 교수와 현재 회사 대표이사인 한동일 박사가 주축이 되고 압타머 사업단의 주요 기술인력이 함께 참여하여 회사를 설립하게 되었고 포항공대가 보유한 압타머 기술자산에 대한 독점적 우선 실시권을 확보하였습니다.
회사 설립 초기에는 압타머 개발 서비스에 주력하면서 글로벌 제약사인 Novartis사와 치료제 표적 공동연구를 성공적으로 완수하였고, 미국의 SomaLogic사, 아산병원과 함께 진단 제품 개발을 위한 상호협력 계약을 체결하면서 압타머 응용 진단제품 개발을 본격적으로 착수하게 되었습니다.
최초로 개발된 폐암 조기진단 키트는 식약처의 3등급 체외진단 의료기기 허가 및 CE 인증을 득하고, KGMP, ISO13485 인증 제조시설을 기반으로 국내 및 해외에서 제품 출시를 준비하고 있으며, 췌장암 등 여러 후속 파이프라인 진단제품 개발도 진행 중입니다.
2016년부터는 사업영역을 치료제 개발까지 확장하였고, 당뇨 및 간암 치료제 2종 치료제에 대한전임상 개발을 현재 진행 중이며, 다수의 글로벌 제약사와 라이센싱 또는 공동개발 방안이 논의되고 있습니다.

압타머사이언스는 글로벌 경쟁력을 갖는 압타머 기술 플랫폼을 기반으로 혁신 치료제 개발을 위한 AlloMAp (Allosteric Modulator Aptamer) 플랫폼, BiFAp (Bi-Functional Aptamer) 플랫폼, 그리고진단 제품 개발을 위한 AptoMIA (Aptamer-based Multivariate Index Assay) 플랫폼을 구축하고 다양한 제품 개발을 진행하고 있습니다.

압타머사이언스는 고성능 압타머를 효과적으로 발굴하는 기술과 발굴된 압타머를 응용목적에 맞게 최적화하는 기술을 보유하고 있고, 이를 바탕으로 한 혁신적인 치료제 개발 기술 및 다지표 진단 제품 개발 기술에 이르기까지 종합적인 압타머 기술 플랫폼을 구축하고 있습니다.
압타머 기술 플랫폼의 대표적인 핵심역량은 우수한 압타머를 발굴하고 응용목적에 맞게 최적화하는 기술입니다. 압타머사이언스가 보유한 변형핵산 SELEX (Systemic Evolution of Ligands by EXponential enrichment) 기술로 발굴된 압타머는 경쟁사의 비변형 핵산 SELEX 기술로 발굴된 압타머와 비교하여 높은 특이도와 결합력을 갖고 있습니다. 이러한 기술적 우위를 기반으로 압타머 발굴 성공률을 높여 단기간에 250종 이상의 표적 분자에 대한 압타머 서열 아카이브를 확보하게 되었습니다. 이와 더불어 세포막 단백질에 특화된 높은 특이도의 압타머 발굴에 사용되는 특허화된 ViroSELEX 기술을 구축하였고, 압타머 쌍 스크리닝 기술, 길이 최적화 기술, 고정화 기술 등을 개발하여 다양한 응용제품 개발에 최적화된 맞춤형 압타머 개발이 가능합니다.
압타머사이언스는 타사 대비 우수한 압타머 성능에 기반하여 외부의 병원/기관/회사의 연구자들이 원하는 다양한 표적에 대한 압타머 서비스를 제공하고 더 나아가 공동연구도 추진하고 있습니다.
한편, 압타머사이언스는 치료제 개발 기술 플랫폼인 AlloMAp 플랫폼과 BiFAp 플랫폼을 기반으로 당뇨치료제, 간암 치료제 등 혁신 치료제를 개발하고 있으며, 다지표 진단 기술 플랫폼인 AptoMIA 플랫폼을 기반으로 폐암진단 제품을 상용화하였고 여러 후속 제품을 개발하고 있습니다.
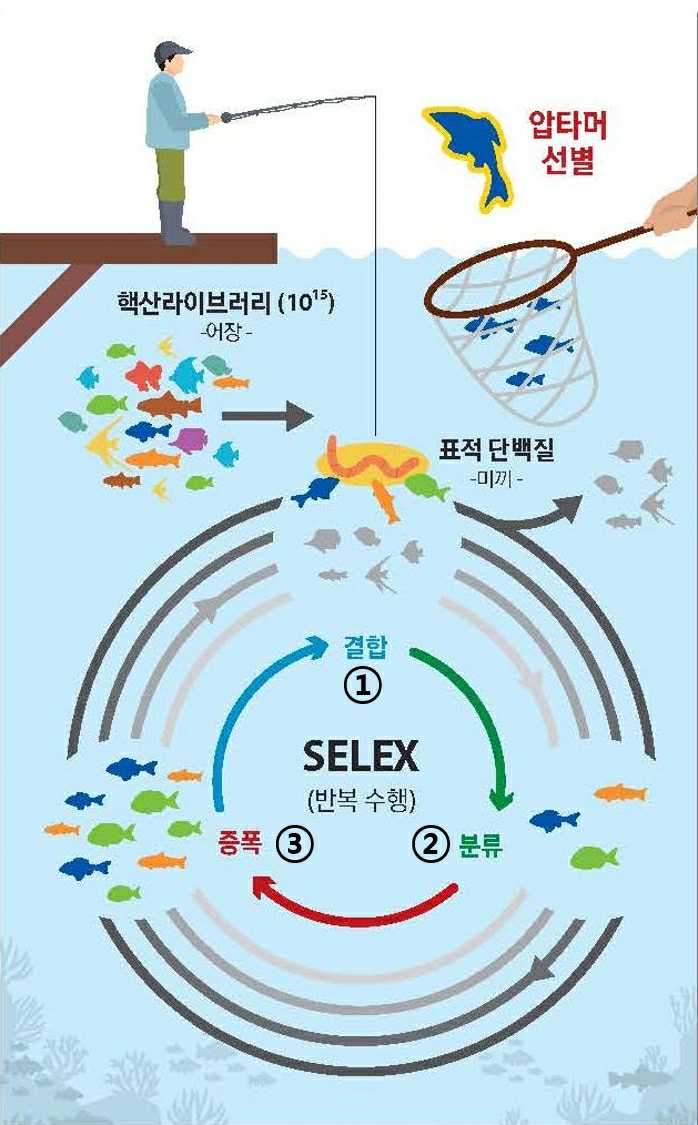
(가) 압타머 발굴기술 (SELEX)
단일 가닥 핵산분자들은 그 자체가 다양한 형태의 안정된 3차 구조를 가지는 구조체 라이브러리로 형성되며 단백질이 3차 구조를 통해 여러 종류의 리간드와 특이적 결합을 하는 것처럼, 구조체로서의 핵산은 단백질은 물론 탄수화물이나 저분자 화합물 등 다양한 종류의 표적에 특이적으로 결합합니다.
1990년 미국 콜로라도 대학의 Larry Gold 박사 연구팀에서 표적 분자에 특이적으로 결합하는 핵산 분자를 압타머 (Aptamer)라고 명명하고, 압타머를 선별하는 기술을 SELEX라고 명명하였습니다.
SELEX는 아래 그림과 같이 핵산 라이브러리로부터 ① 표적 분자에 특이적으로 결합하는 핵산 분자들 선별, ② 결합한 핵산 분자들을 분리하여 ③ 증폭하는 일련의 라운드를 반복함으로써 표적 분자에 친화적으로 결합하는 핵산 분자들을 응집하는 기술입니다.
압타머는 표적 분자에 대한 특이적 결합력을 가지면서, 항체 및 단백질 기반 기술과 구분되는 다양한 특장점을 갖기 때문에 항체가 응용되는 분야는 물론 항체 사용이 어려운 분야에도 적용할 수 있는 차세대 생체 분자로 많은 제약사 및 연구기관들의 기대와 관심을 받고 있습니다.
초기의 압타머는 비변형 천연핵산 기반이기 때문에 화학적 다양성의 부재로 결합력이 충분치 않아 본격적인 상용화에 어려움이 있었으나, 변형핵산 기술 등 기술 혁신이 이루어져항체 대비 동등 내지 우수한 결합력을 갖게 되어 압타머 기술의 상용화를 위한 토대가 만들어졌습니다.
1) 변형핵산 SELEX 기술
천연핵산 라이브러리를 사용하여 발굴되는 압타머는 생체 내 안정성이 떨어지고, 제한적인 화학적 다양성으로 표적 결합력이 낮은 단점이 있어 발굴 이후 화학적인 변형을 통하여 성능을 개량시키는 기술 (Post-SELEX)이 필요합니다.
하지만, Post-SELEX 만으로는 압타머 성능 개선에 한계가 있어, SELEX에 사용되는 핵산 라이브러리 자체에 화학적 변형을 주는 변형핵산 SELEX 기술이 개발되어 압타머 성능의 한계를 극복하게 되었습니다.
변형핵산 SELEX는 핵산의 특정 염기 (base)에 소수성 분자 (hydrophobic moiety)를 도입하는 방식으로 기존의 SELEX 프로세스를 그대로 이용하면서 핵산 라이브러리의 화학적 다양성을 증가시켰기 때문에, 표적 분자와의 결합이 획기적으로 개선된 압타머를 높은 성공률로 발굴할 수 있는 기반을 제공합니다.
변형핵산 기반 SELEX 기술로 발굴된 압타머는 비변형 천연핵산 SELEX 기술로 발굴된 압타머 대비 표적 분자와의 평균 결합력이 10-100배 이상 증가하였으며, pM (피코몰) 수준 Kd의 우수한 결합력을 가지는 압타머도 확보 가능하게 되었습니다.
2) ViroSELEX 기술
세포막에 존재하는 단백질들은 대부분 당화 (glycosylation)와 같은 단백질 번역 후 변형(Post-translational Modification, PTM) 이 있고 세포막 환경에 의해 구조가 결정되기 때문에,정제된 세포막 단백질은 자연에서 존재하는 원형의 상태와 큰 차이를 가지게 됩니다.
세포막 단백질의 압타머를 발굴하기 위해 세포를 사용한 압타머 발굴 (Cell-SELEX)이 진행되었으나 아직 기술적으로 초기 단계에 머물러 있으며, 일부 발표된 연구 결과에서도 발굴의 재현성이 매우 낮고 발굴 과정 또한 상당한 시간과 노력이 소요됩니다.
상기 문제에 대한 해결책으로 압타머사이언스는 표적 단백질을 대리 바이러스 (surrogate virus) 지질막 표면에 원형 상태의 세포막 단백질과 같은 환경으로 발현시켜 SELEX에 사용하는 ViroSELEX 기술개발에 성공하였고, 이를 특허화하였습니다. (특허명: 대리 바이러스를 이용한 압타머 제조 방법, 출원번호: PCT/KR2018/009662)
다음의 표에서 보는 바와 같이 ViroSELEX는 세포막 단백질에 대한 압타머를 발굴하는데 있어 다른 SELEX 기술에 비해 우수한 특성을 보유합니다.
| 【SELEX 종류에 따른 장단점 비교】 |
구분SELEXCell-SELEXViroSELEX(압타머사이언스 기술)
| 표 적 |
표적 분자 | 재조합 단백질 | 세포 표면 세포막 단백질 |
대리 바이러스 외피에 발현된 외래 세포막 단백질 |
| 단백질 형태 | 비원형 | 원형 | 원형 | |
| 당화 여부 | 일부 당화 | 완전 당화 | 완전 당화 | |
| 압 타 머 |
특이도 | 중간 | 낮음 | 높음 |
| 성공률 | 높음 | 낮음 | 높음 | |
| 플랫폼 | 구축 가능 | 구축 어려움 | 구축 가능 | |
| 개발기간 | 4주 이내 | 수개월 | 6-8주 이내 |
(나) 압타머 최적화 기술
선별된 압타머는 응용 제품으로서의 효용성을 높이기 위해 최적화 과정을 거치게 되는데, 압타머사이언스에서는 길이 최적화, 화학적 최적화, 고형체 최적화, 압타머 쌍 스크리닝 등의 포괄적인 최적화 기술을 구축하여 응용 제품 목적에 맞는 최상의 구조와 효능을 갖는 압타머를 도출할 수 있습니다.
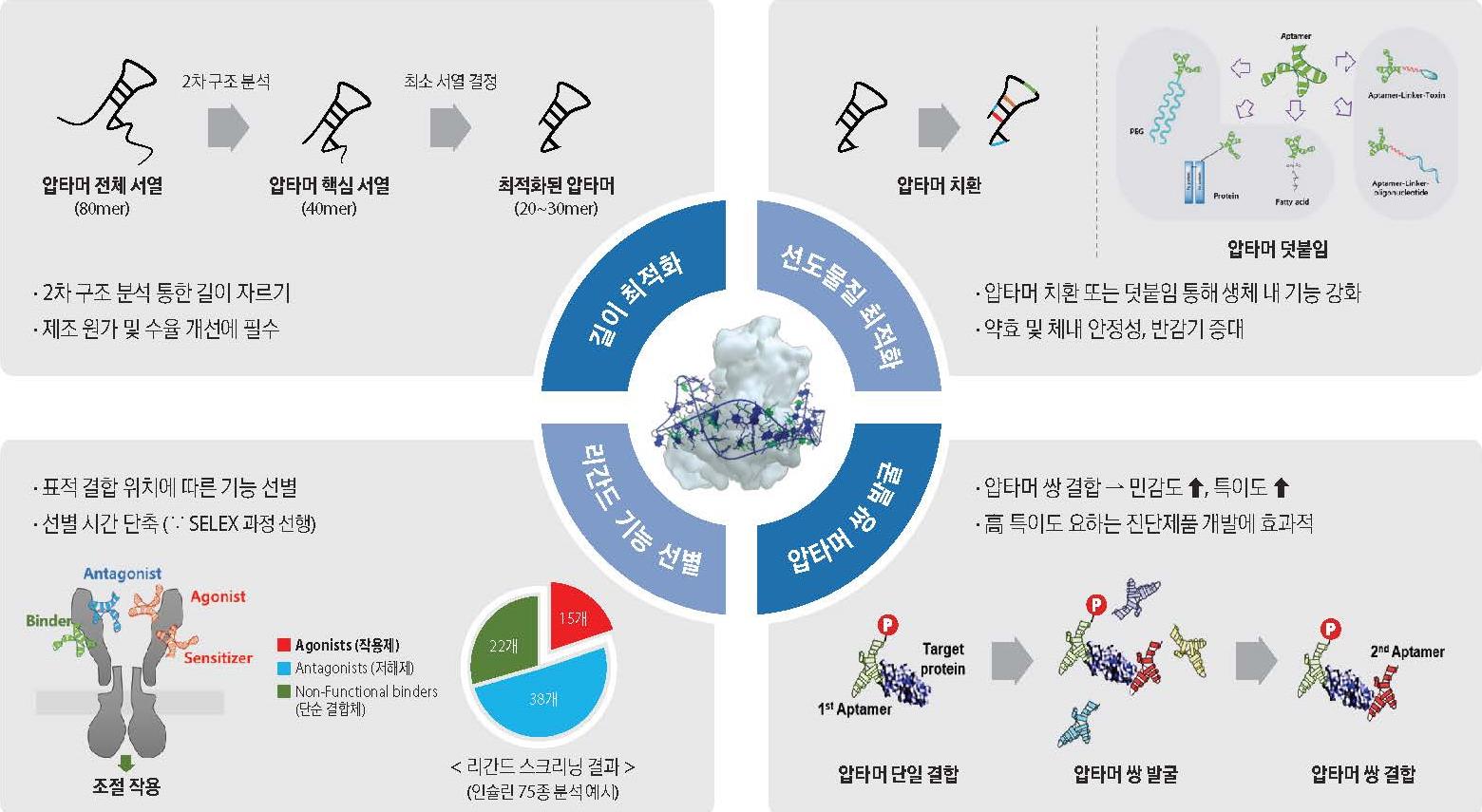
1) 길이 최적화 기술
선별된 유효물질 압타머는 mfold (RNA institute)와 RNA structure (Mathew Lab)와 같은 2차구조 예측 프로그램을 이용하여 구조를 분석하고 표적 결합을 위한 압타머 구조를 예측할 수 있습니다.
선택된 압타머 2차 구조 예측 프로그램을 이용, 분석하여 구조에 영향을 미치는 stem과 loop을 형성하는 필수 서열을 제외한 나머지 서열을 제거하는 압타머 길이 최적화 과정을 거치게 되면 동일한 수준의 결합력을 유지하면서 압타머를 20~30mer로 줄일 수 있어 생산수율이 향상되고 단가를 대폭 낮출 수 있게 됩니다.
2) 화학적 최적화 기술
핵산 분해효소 (nuclease)에 대한 저항성을 높이기 위하여 당쇄의 2' 위치에 OH 대신에 F,NH2, OMe 그룹을 도입할 수 있으며, 신장을 통한 빠른 배출을 막아 체내 머무름 시간을 조절하기 위하여 말단에 PEG (polyethylene glycol)와 같은 고분자나 지방산 (fatty acid)을고정화 (conjugation)할 수 있습니다.
약물을 특정 부위에 전달하는 목적으로 사용하기 위해 ADC (Antibody-Drug Conjugate)와 유사하게 압타머에 독성 물질이나 다른 작용기전의 약물을 결합시키는 기술을 보유하고 있습니다.
3) Labeling 및 고형체 고정화 기술
압타머를 다양한 분야에 응용하고자 할 경우 압타머의 5'-말단이나 3'-말단, 또는 중간구조에 손쉽게 다양한 분자 moiety를 결합할 수 있습니다. 압타머 자체에 형광기나quencher 분자 등을 부착하여 in vivo (생체 내) 영상센서에 활용하거나, NOTA-, DOTA-와 같은 킬레이터를 이용, 방사선동위원소 물질을 결합시켜 PET 이미징에 적용할 수 있는 기술을 보유하고 있습니다. 압타머는 항체보다 크기가 작기 때문에 조직 침투성이 우수하고 관찰 시간 이후에는 쉽게 체외로 배출되어 영상 프로브 (probe)로사용하기에 적합합니다.
4) 압타머쌍 스크리닝 기술 (PAIR-SCAN)
SELEX 과정에는 표적 분자와 결합하는 다양한 염기서열을 가진 압타머 클론들이 확보되며, 이들 중 일부는 표적 분자내 동일 부위에 결합하는 것과 서로 다른 부위에 결합하는 것들이 함께 존재합니다. PAIR-SCAN 기술은 압타머 클론들 사이의 경쟁 (competition) 반응을 통해 동일한 표적 분자에 결합 부위가 서로 다른 압타머를 선별하는 기술로서 표적 분자 검출을 위한 압타머쌍 확보가 가능합니다. (특허명: Aptamer Sandwich Assays, 등록번호: US8785132)
압타머사이언스가 보유한 핵심기술역량을 기반으로 압타머 치료제 개발 시스템을 구축하여 표적에 대한선도물질 발굴로 부터 최적화를 거쳐 개발 후보 물질을 도출하기까지 전과정을 3년 내에 완료할 수 있습니다. 일반적인 치료제 개발에서 통상 5-7년 소요되는 과정을 대폭 단축시킨 경쟁력 있는 기술 기반입니다.
1) AlloMAp (Allosteric Modulator Aptamer) 플랫폼
AlloMAp 플랫폼은 세포막 수용체의 알로스테리 결합 부위에 작용하는 압타머 치료제 후보 물질을 개발하기 위한 압타머사이언스의 플랫폼 기술입니다. 치료제로서 우수한 특징을 가지는 알로스테리 신약개발의 어려움을 압타머 기반 기술로 극복한 치료제 개발 기술 플랫폼입니다.
2) BiFAp (Bi-Functional Aptamer) 플랫폼
높은 표적 선택성을 보유하고 화학적 변형이 용이한 압타머의 특징을 활용하여 기존 약물이나 다른 기능적 모듈을 압타머 분자 내에 집적시킨 압타머 복합체 치료제 개발 플랫폼입니다.
압타머는 높은 특이도, 보관 안정성, 생산 및 타소재와의 결합이 용이한 점 등 기본적으로 진단소재로 사용하기에 매우 적합한 소재이며, PCR 증폭을 통해 매우 뛰어난 검출한계가 가능하다는 점까지 더해져 진단법 개발에 매우 특화된 소재입니다.
1) AptoMIA (Aptamer-based Multivariate Index Assay) 플랫폼
다양한 원인에 의해 생기는 암질환은 단일 바이오마커로 진단하는 것은 어려움이 있으므로 다수의 바이오마커를 측정하여 민감도와 특이도를 높이는 다지표 진단법 (IVDMIA)으로진단 패러다임이 변하고 있습니다. 다지표 진단법은 다수의 바이오마커에 대한 측정값을 입력하여 특정 알고리즘에서 계산된 지표 (index)로 진단정보를 제공하므로 높은 민감도와 특이도로 위양성률을 줄일 수 있습니다
미국 FDA에서는 일찍이 2006년부터 체외진단 다지표 검사의 의학적 유용성과 연구 활성화를 예견하여 판정 기준을 수립함에 따라 해외에서는 유전자 또는 단백질 기반 다지표 검사 제품이 활발하게 출시되고 있습니다. 한국 식약처에서도 2016년도에 체외진단 다지표 검사용 의료기기 허가/심사 가이드라인을 발표하였습니다.
AptoMIA 다지표 진단기술은 일련의 과정을 통해, 생체 시료에 존재하는 바이오마커들의 농도가 압타머 농도로 전환되어 이를 분석함으로써 측정할 수 있는 기술입니다.
다수의 바이오마커 특이적인 압타머들을 하나의 웰 (well)에서 혈액시료와 반응시키고 (단백질-압타머 결합), 결합된 압타머들의 각각의 농도를 측정함으로써 결합 단백질의 농도를 비드 마이크로어레이 (bead microarray) 기술과 mPCR (multiplex PCR) 기술을 이용하여 정량 분석하고 (압타머 정량), 특정 알고리즘으로 분석하여 진단정보를 제공하는 단계로 구성됩니다.
2) AptoPOC (Aptamer-based Point-Of-Care) 플랫폼
AptoPOC 현장진단 플랫폼은 혈액, 인후분비물, 뇨내 바이오마커 특이적인 압타머쌍 기반측방유동면역분석 기술로 15분 이내에 특정 질환 또는 감염성 바이러스 진단결과를 정성,정량분석으로 확인할 수 있는 기술입니다.
압타머사이언스의 압타머쌍 스크리닝 기술 (PAIR-SCAN)을 통해 발굴된 높은 특이성의 압타머쌍을 사용하여 타 바이러스와의 변별력이 우수하고 진단 정확도가 높습니다.
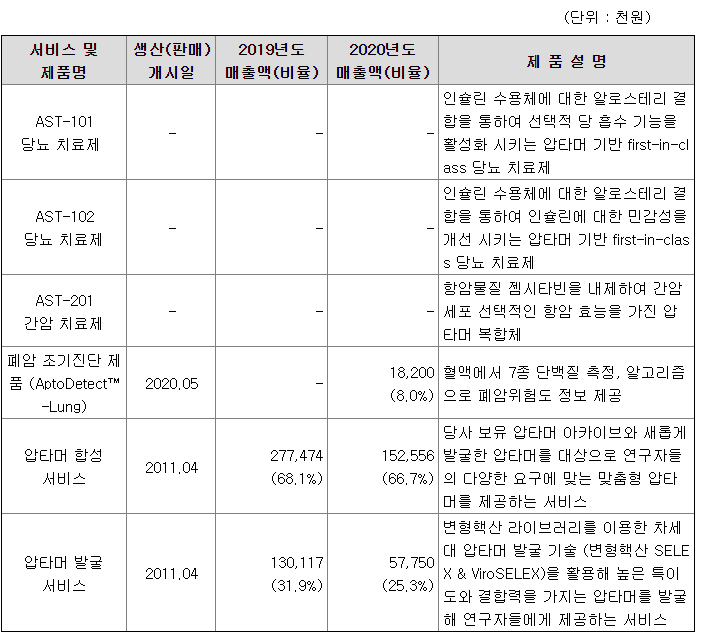
(가) AST-101 당뇨 치료제: 인슐린 대체제
| 제품명 | AST-101 당뇨 치료제 |
| 제품 개요 | 인슐린 수용체에 대한 알로스테리 결합을 통하여 선택적 당 흡수 기능을 활성화시키는 압타머 기반 first-in-class 당뇨 치료제 |
| 제품의 특징 |
- 인슐린 수용체 활성화를 통한 충분한 혈당강하 효능 - 당 흡수에 관련된 기능만 선택적으로 활성화 및 세포 성장 미유도 - 인슐린 수용체의 내재화 미유도로 인슐린 민감성 유지 - 안정적인 약동학적 특성을 확보하여 저혈당 위험 감소 - 수용체 특이성 확보로 표적 외 작용에 따른 부작용 문제 해결 |
| 목표시장 | - 지속형 인슐린 투여가 필요한 당뇨 환자 시장 (2016년 기준 78억불) - 고용량 인슐린 치료를 요하는 SIRD (Severe Insulin-Resistant Diabetes) 환자 시장 (2018년 기준 9.2억불) |
1) 특징
AST-101은 인슐린 수용체와 결합하지만, 인슐린과는 다르게 알로스테리 결합을 통해 세포 성장 및 증식과 관련된 ERK 신호의 활성 없이 당 흡수 기능과 관련된 PI3K/AKT 신호만을 활성화해, 기존 인슐린 기반 치료제가 가지는 부작용 (체중 증가, 심혈관 질환의 위험)없이 혈당조절이 가능하게 합니다.
2) 적응증
식후 혈당 조절을 위해 24시간 이상 지속적인 혈당 유지가 필요한 제1형 및 2형 당뇨병 환자의 치료제로 사용될 수 있습니다. 나아가, 기저 인슐린 치료제의 장기 투여시에 발생하는 인슐린 저항성을 나타내는 당뇨 환자에 사용될 수 있습니다.
부작용 문제에도 불구하고 고농도 인슐린 제제에 의존하는 비만이면서 인슐린 저항성이 높은 SIRD 환자에 사용될 수 있습니다.
(나) AST-102 당뇨 치료제: 인슐린 민감제
| 제품명 | AST-102 당뇨 치료제 |
| 제품 개요 | 인슐린 수용체에 대한 알로스테리 결합을 통하여 수용체의 인슐린 민감성을 증가시키는 당뇨 치료제로서 새로운 기전을 가진 압타머 기반 first-in-class 당뇨 치료제 |
| 제품의 특징 |
- 인슐린 수용체를 타겟으로 하는 최초의 인슐린 민감제 - 내인성 인슐린 또는 적은 용량의 인슐린만으로 효과적인 혈당조절 - PPARγ와는 독립적인 작용기전으로 기존 TZD (Thiazolidinediones) 계열 치료제들이 갖는 부작용 우려 해소 - 높은 선택성으로 off-target (유사 성장호르몬 수용체 등) 부작용 최소화 |
| 목표시장 | - 인슐린 저항성을 동반한 제2형 당뇨 (TZD 계열 약물 퇴출 전 2006년 시장: 71.2억불) |
1) 특징
AST-102 당뇨 치료제는 인슐린 수용체에 대한 알로스테리 결합을 통하여 수용체 자체의 인슐린 민감성을 개선시키는 압타머 기반 first-in-class 당뇨 치료제입니다.
기존 TZD계 약물을 포함하여 인슐린 민감제의 주요 표적 기전인 PPARγ 아고니스트가 아닌, 인슐린 수용체에 직접 작용하여 부작용 위험이 낮으면서 수용체의 민감성을 증가시키는 기전은 압타머사이언스의 AST-102가 유일합니다.
인슐린 수용체에 직접 작용하여 인슐린 민감성을 높이기 때문에 내인성 인슐린 또는 저용량의 인슐린만으로 혈당조절이 가능할 수 있어 저혈당 위험이 적은 안전한 치료제입니다.
2) 적응증
인슐린 민감제의 주요 적응증은 인슐린 저항성을 동반한 2형 당뇨입니다. 전체 당뇨 환자의 90% 이상을 차지하는 2형 당뇨는 인슐린 저항성으로 인해 혈당이 적절히 조절되지 못하고 그에 따른 고인슐린혈증, 고혈당, 고지혈증 등의 증상과 함께 지속적으로 악화될 경우 췌장 베타세포의 손상으로 이어져 정상적인 인슐린 분비가 이루어지지 못하게 됩니다.
인슐린 민감제는 인슐린 저항성 개선을 통해 당뇨의 근본적인 치료를 목표로 하는 약물로 현재까지는 TZD 계열의 약물이 유일한 인슐린 저항성 개선 치료제입니다. 그러나, 2007년까지 비인슐린계 2형 당뇨 치료제에서 가장 큰 시장을 차지하고 있던 TZD계는 간독성, 심혈관계 위험성 및 기타 부작용으로 인해 현재는 매우 제한적으로 사용되고 있는 실정입니다.
TZD 이후 인슐린 민감제는 등장하지 않고 있으나, 당뇨 치료에 있어서 인슐린 저항성 개선에 대한 미충족 의학적 수요는 매우 크며, 따라서 신규 작용기전에 기반한 인슐린 민감제 치료제의 개발은 당뇨 환자들에게 치료의 다양성 및 근본적 치료를 제시해 줄 수 있습니다.
(다) AST-201 간암 치료제
| 제품명 | AST-201 간암 치료제 |
| 제품 개요 | 간암 세포 특이적 세포막 바이오마커 단백질인 글라이피칸3 (GPC3)에 선택적으로 결합하고 세포 독성 물질인 젬시타빈 (Gemcitabine)을 내재화한 표적형 압타머 치료제 |
| 제품의 특징 |
- 간암 세포에 선택적인 약물 전달 (부작용 최소화) - GPC3 의존적 세포 내재화로 젬시타빈 내성 극복 - BiFAp 형태로 젬시타빈 활성 유지 - BiFAp의 높은 조직 침투력과 신장을 통한 배출 (renal clearance)로 넓은 치료계수(therapeutic index) 확보 가능 - 기존 승인된 간암 치료제(Sorafenib 등)과 다른 MOA로 synergistic 효과 기대 |
| 목표시장 | - Hepatocellular carcinoma (2017년 기준 5.1억불) |
1) 특징
표적 물질인 글라이피칸3 (GPC3)는 간암세포에 특이적으로 발현하는 전암성 병변 (간경화)를 효과적으로 구분할 수 있는 세포막 단백질이며, GPC3 발현 정도와 생존율간의 상관관계가 높아 간암 치료제 개발을 위한 우수한 표적 분자입니다. 검증된 항암 치료제인 젬시타빈을 GPC3 압타머에 도입하여 항암 기능을 가지면서 GPC3에 대하여 기존 압타머와 동일한 수준의 결합력을 가진 BiFAp계 압타머입니다.
젬시타빈을 BiFAp 분자 내에 내재화함으로써 생체내 Cytidine deaminase (CDA) 대사 프로세스로 인해 효능이 상실되는 위험을 해소시키며, 젬시타빈의 주요 내성 기전인 Nucleoside transporter의 변형과 상관없이 GPC3를 통한 간암 세포로의 능동적 약물 전달을 통해 높은 치료 효과를 나타냅니다. 또한, 단일 BiFAp 분자에 복수의 젬시타빈을 내재화하고 압타머의 강한 결합력으로 효과적인 암세포 전달을 일으키기 때문에 낮은 최소 효능 용량 (MED) 확보가 가능합니다.
항체에 비해 빠른 신장 배출로 독성물질에 의한 부작용을 줄여 높은 수준의 최대 내성 용량 (MTD) 확보가 가능하기 때문에 기존 항체기반 ADC 기술에서 확보하지 못한 넓은 범위의 치료 계수 (Therapeutic Index)를 보여줍니다.
2) 적응증
압타머사이언스의 제품은 간세포 암 (HCC, Hepatocellular carcinoma)이 발생한 환자를 목표로 합니다. 간암은 Hepatocellular carcinoma (HCC)가 75-90%를 차지하며, B형 및 C형 간염 바이러스, 제2형 당뇨, 비만, 간경화 등이 주요 원인으로 발생합니다. 간세포 암은 매우 빠른 성장속도를 가지고 있으며, 간암 진단 후 생존기간의 중간값은 10개월 내외입니다.
현재 간암에 대해 허가된 치료제는 VEGFR 표적 저해제 (Sorafenib, Regorafenib) 이거나 VEGF 항체 (Ramucirumab)와 같은 혈관 형성 억제 기전을 가지고 있지만, Sorafenib은 낮은 효능 (생존 기간 2-3개월 연장), Sorafenib 미반응 환자들에 대한 2차 치료제로 인정받은 Ramucirumab (Cyramza)은 1. 2개월 생존 기간 개선 효과에 불과합니다.
다양한 기전의 약물들이 임상개발 단계에 있지만, 효능과 독성 문제로 인해 효과적인 치료목표를 달성하지 못하고 있습니다.
압타머사이언스 주요 제품
압타머사이언스 매출액

'기업분석 > 제약-바이오' 카테고리의 다른 글
| 대웅제약 매출 및 주가전망 - 의약품 제조 및 판매, 나보타, 우루사, 올메텍, 임팩타민, 가스모틴 (0) | 2021.10.11 |
|---|---|
| 피에이치씨(필로시스헬스케어) 매출 및 주가, 바이오사업, 유통사업 및 임대사업 (0) | 2021.10.10 |
| 바이오리더스 매출 및 주가전망 - 폴리감마글루탐산(γ-PGA)의 원료(소재)사업,건강기능식품 및 기능성화장품사업 (0) | 2021.10.08 |
| 제놀루션 매출실적 및 배당금 - 핵산추출기기 및 시약, RNAi 관련 사업 (0) | 2021.10.07 |
| 아이진 매출실적 - 신약 연구 개발 (0) | 2021.10.06 |


댓글