"주식회사 셀리드"라고 표기합니다. 영문으로는 Cellid, Co., Ltd. 라고 표기합니다. 약식으로 표기할 때는 (주)셀리드 또는 Cellid라고 합니다.
중소기업에 해당합니다. 벤처기업입니다.
연구중심의 항암면역치료백신 및 COVID-19 예방백신 개발 전문 바이오벤처기업으로서 2006년 12월 11일 서울특별시에 설립되었습니다.
| 주소 | 서울특별시 관악구 관악로 1 서울대학교 142동 5층 |
| 전화번호 | (02) 3285-7860 |
| 홈페이지 | www.cellid.co.kr |
지난 2006년에 설립되어 항암면역치료백신과 COVID-19 예방백신을 개발하고 있습니다. 항암면역치료백신은 제품별로 임상시험ㆍ비임상시험을 진행하고 있으며, COVID-19 예방백신 AdCLD-CoV19은 임상개발을 진행 중으로 2020년 12월 4일 식품의약품안전터로부터 임상 1/2a상 시험 계획(IND) 승인을 득하였습니다.
셀리드의 2020년 배당금은 없습니다.

암이란 세포에 발생한 돌연변이에 의해 정상세포가 비정상적으로 세포분열을 일으켜 발생하는 질병입니다. 형태에 따라 고형암과 혈액암으로 나뉘는데 고형암은 체내 조직이나 장기에 덩어리(종양)를 형성하는 질환이고 혈액암은 특정한 혈액세포가 비정상적으로 증식하면서 미성숙 혈액세포가 증가되는 등 인체의 기능이 비정상적으로 작동하여 손상을 입게 되는 것을 말합니다.
항암치료의 방법으로는 절제수술, 방사선요법 및 화학요법이 대표적입니다. 수술을 통한 병변의 절제는 완치를 기대할 수 있는 가장 근원적인 방법으로 조기에 발견, 진단된 암에서는 적극적으로 수술을 고려할 수 있습니다. 수술과는 별개로 또는 수술 전/후에 방사선요법이나 화학요법(화학항암제)을 실시할 수 있는데 두 방법 모두 암의 증식원리인 세포분열 과정을 억제하거나 차단하여 암의 진전을 막는 치료방법입니다. 방사선요법은 에너지가 높은 방사선을 쬐어 암세포의 사멸을 유도하고, 화학요법은 세포독성항암제와 같은 화합물을 경구투여 또는 정맥으로 주사하여 암세포의 사멸을 유도합니다.
하지만 이러한 고전적 치료방법은 암세포와 정상세포를 구분하여 치료하는 것이 아니기 때문에 정상세포에도 방사선이나 세포독성항암제의 작용이 나타나 심각한 부작용을 일으키며, 이로 인해 암세포만 선택적으로 공격할 수 있는 새로운 치료법에 대한 연구가 계속되었습니다. 그 결과 개발된 것이 2000년대의 표적항암제입니다.
표적항암제는 암세포에만 특이적으로 높게 발현되는 단백질이나 신호전달체계에만 작용해 암세포를 억제하는 치료기전을 가지고 있습니다.
따라서 무차별적인 방사선요법이나 세포독성항암제와는 달리 정상세포는 공격하지 않아서 상대적으로 항암효과는 있으면서 부작용은 매우 약하거나 거의 나타나지 않는 것이 특징입니다. 하지만 돌연변이가 흔하게 일어나는 암세포/조직에서는 표적항암제를 무력화시키거나 표적단백질 외에 다른 단백질을 통해 생장을 이어가는 방식을 표출하는 등 단기간에 표적항암제에 내성을 획득하는 기전이 보고된 바, 이를 극복하기 위한 더 나은 발전이 필요하였습니다. 여기에 면역항암제로 최초의 면역관문억제제인 여보이가 출시되면서 항암치료의 새로운 장이 열렸고, 면역항암제는 우리 몸의 면역체계를 이용하여 암을 치료하는 방법으로 효과 및 안전성 측면에서 큰 주목을 받고 있습니다.

모든 항암치료방법은 현재 각각 단독으로 또는 다양한 병용의 방법으로 환자들에게 사용되고 있으며 따라서 현재 세계 항암제 시장은 특성이 상이한 방사선 치료를 제외하면 전통적인 화학항암제와 표적항암제, 면역항암제로 구분되어 발전하고 있는 상황입니다. 특히 면역항암제의 개발 및 성장속도가 매우 높습니다.
(가) 항암면역치료제 시장
2018년 전 세계 항암제 시장은 1,500억 달러 규모에 이르렀으며, 이 중 면역항암제 부문은 193억 2,600만달러로 전체의 약 13%를 차지하였습니다. Evaluate Pharma의 전망에 따르면 글로벌 의약품 시장 중 항암제 시장은 2024년까지 연평균 전년 대비 +11.4%로 성장할 것으로 예상되며, Market Data Forecast의 2019년 보고서에 따르면 항암면역백신 시장은 2019년 46억 달러에서 2024년 101억 달러 규모로 연평균 117.3%의 고성장을 보일 것으로 전망됩니다.
(나) 항암면역치료제의 발전 및 현황
2010년 최초의 면역항암제이면서 최초의 수지상세포백신인 Dendreon의 Provenge가 승인된 이후, T세포 면역조절항체인 Yervoy가 2011년 승인을 받으면서 면역항암제의 시대가 시작되었습니다.
이후 PD-1, PD-L1 저해제로 대표되는 면역관문저해 항체의약품 6종이 순차적으로 승인되었습니다. 2019년에는 중국에서만 신규 면역관문저해 항체의약품 3종이 추가로 승인되었습니다. 다른 기전으로서 이중항체와 항암바이러스, 최초의 유전자 조작 면역세포치료제인 CAR-T 2종이 승인되었습니다. 2세대 면역항암제는 2015년부터 거대한 신규시장을 창출하기 시작하였으며, 차세대 면역항암제, 항암면역 요법이 속속 개발되고 있습니다. 이를 그림으로 정리하면 다음과 같습니다.
면역항암제 제품과 발전 단계

차세대에 속하는 면역항암치료제는 CeliVax와 같은 세포기반 치료백신이 주류를 이루고 있습니다.
면역항암제는 개발의 순서 외에 암항원 특이적인 타깃을 보유한 제품인지 또는 환자 자신의 항암면역작용 활성화를 수반하는 능동성이 필요한지의 관점에 따라 다음과 같이 구분할 수 있습니다.

수동형 제품은 제품 자체가 제조과정에서 활성화되어 환자에게 투여 시 곧바로 직접 암세포에 작용하는 의약품으로, 자연살해세포, T세포 등의 adoptive cell therapy (입양세포치료제)가 대표적입니다. 이 기전이 승인된 제품에는 CAR-T가 2종 (미국, 유럽), 이뮨셀-LC (한국) 등이 있습니다. 능동형 제품은 환자의 항암면역작용을 활성화시키는 작용기전으로 환자 자신의 면역기능이 활성화되어야 효력이 나타나는 의약품입니다.
수지상세포백신 Provenge (미국)가 승인된 바 있고, 재조합 사이토카인, 면역관문저해 항체, 항암바이러스 등 수 종의 제품이 출시되었거나 개발 중에 있습니다. 능동형 제품은 환자의 면역기능이 정상적으로 작동하고 있을 때 큰 효력을 기대할 수 있는 반면, 일단 효력이 나타난 경우 장기간의 항암효과를 기대할 수 있다는 큰 장점이 있습니다. 항원특이성 면에서 보면 암세포에 특이적으로 발현하는 암항원을 타깃하는 경우 암세포만 특이적으로 살상하므로 부작용 발생이 낮은 장점이 있습니다.
여기에 해당하는 제품으로 치료백신, CAR-T, CAR-NK, 종양침윤림프구 등이 있습니다. 암항원 비특이적인 작용기전을 갖는 자연살해세포, 사이토카인, 면역관문저해제 등은 암항원과 무관하게 면역반응을 활성화하므로 종종 자가면역질환 유사 부작용 등이 발생하곤합니다. CeliVax 기술은 능동형 제품이면서 암항원특이적으로 개발되어 두가지 특성의 장점을 고루 갖춘 치료제입니다.
(다) 면역항암제 시장 특성
면역항암제는 작용기전이 동일한 의약품 간에는 경쟁관계가 있으나, 서로 다른 작용기전의 의약품인 경우 병용투여 또는 순차투여 등 다양한 약제를 보완적으로 사용할 수 있는 치료방법의 개발이 필요하고 또 활발한 상황입니다. 최근 면역관문저해 항체의약품과 타 면역항암제 간 다양한 병용투여 임상시험이 급증하고 있는 것도 이러한 이유입니다 (그림 면역관문저해제의 병용투여 임상시험 현황).
대표적인 면역관문저해제를 보유한 MSD가 자사의 Keytruda와 타 면역항암제의 병용투여 임상시험을 650건 이상 진행 중인 것도 이러한 관점에서 이해할 수 있습니다. 더불어 기본치료 옵션으로 환자에게 권유되는 화학항암제 기반 치료에도 면역항암제는 병용투여 또는 순차투여를 고려할 수 있어 광범위한 암종에서 지속적으로 시장이 확대되는 효과가 있습니다. 따라서 단독제제로서의 안전성과 유효성이 확립된 이후 면역관문저해제 및 기존 항암치료제와의 병용/순차 투여 연구를 통해 표준치료법으로 인정받는 것이 면역항암제 시장에 성공적으로 진입하는 좋은 방법입니다.

(라) 항암면역치료백신 시장
안전성 측면에서 항암면역치료백신의 프로필이 면역관문저해제보다 유리한 경우가 많다는 점을 고려하면 향후 암환자의 복합치료요법에서 항암면역치료백신이 유망한 후보가 될 것으로 전망됩니다.
중증의 전신 부작용이 발생할 우려가 있는 전통적인 화학약물요법제, 내성이 쉽게 발생하는 표적항암제들에 비해서도 우수한 제품 프로필을 가지고 있으므로 궁극적으로 환자의 치료성과를 높여 전체 생존기간을 증가시키고 더 많은 치료 기회를 제공할 수 있는 제품으로 시장 성장을 드라이브할 잠재력이 있습니다. 현재 항암면역백신류로는 자궁경부암 예방백신으로 잘 알려져있는 Gadasil (Merck)과 Cervarix (GlaxoSmithKline)를 제외하면 치료용 백신으로는 아직 시장을 주도하는 제품이 없는 상태입니다.
항암면역치료백신에는 대표적으로 수지상세포를 이용한 항암면역치료백신이 있으며, 이에 해당하는 Provenge (Dendreon)가 2010년 미국에서 허가를 받았습니다. Provenge는 전이성 전립선암 치료제로서 환자 1인당 치료비는 $93,000이며, 미국 메디케어 내 가장 비싼 항암제로 등록되어 있습니다.
해외에서 항암면역치료백신 파이프라인을 보유한 기업은 Advaxis, Bavarian Nordic, Inovio, Northwest Biotherapeutics, Moderna Therapeutics 등이 있습니다. Bavarian Nordic은 2015년에 전립선암 치료제인 PROSTVAC의 파이프라인을 BMS로 9.75억 달러에 기술 이전하였습니다.
BMS는 자사의 면역관문저해제와 항암면역치료백신의 병행요법을 개발하기 위해 이 파이프라인을 도입한 것으로 알려져 있습니다. PROSTVAC은 수두바이러스를 이용해 PSA 항원을 도입하는 방식을 취하고 있으며, 임상 3상을 진행 중이나 1차 평가변수인 환자의 수명을 연장하는데 실패한 것으로 알려졌습니다. Inovio는 2015년 자궁경부암과 두경부암 치료제인 INO-3112의 파이프라인을 7.3억 달러에 MedImmune에 기술 수출하였습니다.
INO-3112는 plasmid DNA기반의 항암면역치료백신이며, 자궁경부암을 대상으로 임상 1/2상을 완료하였고, 두경부암을 대상으로 임상 2상을 진행 중입니다. Moderna Therapeutics는 mRNA 기반의 항암면역치료백신을 개발하였습니다. 2016년 Merck로 mRNA를 이용한 항암면역치료백신을 최대 2억달러의 계약금을 받고 기술 이전하였으며, Merck는 자사의 면역관문저해제인 Keytruda와 Moderna 치료제의 병용요법을 연구할 계획입니다.
(3) 코로나바이러스감염증-19(COVID-19) 예방백신
(가) COVID-19 예방백신 시장
백신은 개발 플랫폼에 따라 다양하며 각 플랫폼마다의 장단점이 있고 이는 연구개발기간 및 생산 과정에 영향을 미칩니다. 현재 개발 중인 COVID-19 예방백신 플랫폼과 그 장단점은 다음과 같습니다(OECD Treatments and a vaccine for COVID-19: The need for coordinating policies on R&D, manufacturing and access).

이전에 개발되었던 백신들의 사례에 비추어볼 때, 새로운 백신의 개발 완료까지 평균적으로 6~9년이 소요되었습니다. 그러나 COVID-19의 경우, 대유행(Pandemic)으로 긴급한 백신 개발을 촉구하고 있고 다양한 플랫폼으로 개발이 진행되고 있습니다.
이에 따라 1/2상, 2/3상 복합임상시험 진행 및 일부 국가에서의 제한적 승인으로 일반적으로 소요되는 기간보다 더 빨리 개발이 완료될 것으로 예상하며, 실제로 모더나 및 화이자 사의 백신이 2020년 말 FDA의 긴급사용승인(EUA)을 받았고 아스트라제네카의 백신은 2021년 2월 WHO의 긴급사용목록에 등재되었습니다.
다만, 신속한 시판허가가 모든 사람에 대한 신속한 백신 투여로 이어지는 것은 아닙니다. 따라서, 특정 백신의 시판허가 이후에도 최대한 많은 사람에게 신속히 백신을 투여하기 위해서는 적절한 가격으로 충분한 양의 백신을 생산할 수 있어야 합니다.
유럽 국가들은 COVID-19 전파 모델의 기초 감염 재생산 수(Basic reproduction number)를 약 2~4 정도로 추정하며, 이는 집단 면역에 도달하기 위해 인구의 약 50~75%가 면역을 확보해야 함을 의미합니다(Flaxman, S. et al. (2020), Estimating the number of infections and the impact of non-pharmaceutical interventions on COVID-19 in 11 European countries). 이를 전세계적으로 확장시키면, 약 40~60억 명에게 백신을 접종해야 전세계적인 집단 면역을 확보할 수 있습니다.
맥킨지가 발표한 코로나19 백신 개발 분석자료(On pins and needles: Will COVID-19 vaccines `save the world`?)에 따르면 2021년 말까지 80~90억 회 접종량이 전 세계에 공급될 것이라고 예상했습니다. 또한, 전 세계 인구를 한꺼번에 접종하는 것은 불가능하고 현재 개발되고 있는 백신의 투여 횟수는 대부분 2회 접종이므로 백신 접종은 수년에 걸쳐 이루어질 것으로 예상할 수 있습니다.
(주)셀리드가 개발 중인 COVID-19 예방백신은 바이러스 전달체 기반 백신으로 전달체로는 아데노바이러스를 사용하고 있습니다. 위 표에 작성한 바와 같이, 아데노바이러스 전달체 기반 백신은 감염성이 있는 COVID-19 병원체를 사용하지 않으며 생산이 용이합니다.
또한, 면역 증강제 없이 단회투여만으로 면역반응을 유도함을 설치류와 영장류 효력시험에서 보인 바 있습니다. 특히, 영장류 효력시험에서 백신을 1회 투여한 후 코로나바이러스로 감염시킨 결과, 상기도 및 폐에서 바이러스가 검출되지 않았으며 영장류 혈청을 이용하여 중화능력을 비교한 결과, 감염력이 높은 것으로 알려진 D614G 돌연변이 코로나바이러스에서도 동등한 수준의 중화능력을 확인했습니다.
(나) COVID-19 예방백신 개발 및 현황
2021년 2월 부로 73개의 후보 백신의 임상시험이 진행 중이고, 이 중 17개가 임상 3상에 진입하였습니다. 추가로, 최소 182개의 후보 백신이 전임상 개발 단계에 있습니다(WHO DRAFT landscape of COVID-19 candidate vaccines). 다음 표에는 2/3상 단계 이상의 임상시험만 수록하였습니다.
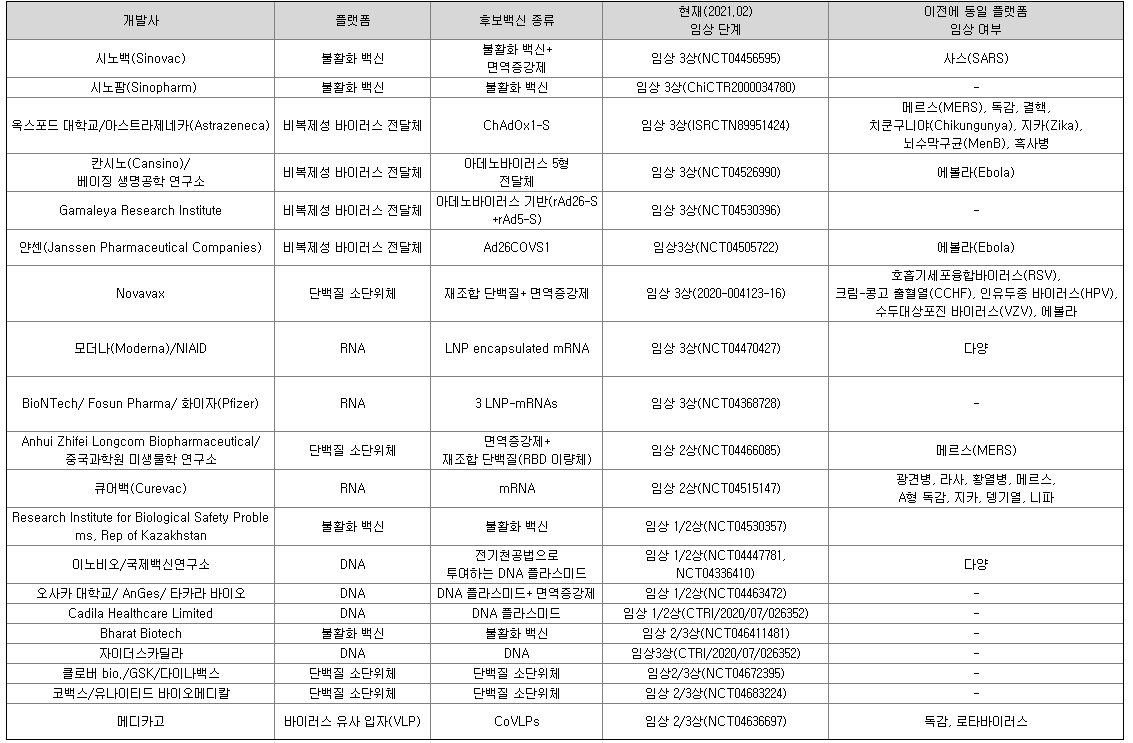
2021년 2월 24일 기준 코로나19 확진자가 1억 1천만명을 넘어서고, 사망자가 247만명을 넘어섰습니다. 2020년 12월 8일 영국은 백신 접종을 개시하여 1,800만명 이상이 1회 접종을 완료했고,(GOV.UK, vaccination in United Kingdom), 미국에서도 2020년 12월 15일 접종을 시작하여 8,800만 도즈가 공급되었습니다.(CDC, COVID-19 vaccinations in the United States). 대한민국 정부도 화이자 백신 1,300만명분, 아스트라제네카 백신 1천만명분을 포함한 총 7,900만명 분의 백신 도입을 확정하였습니다. 이와 같이 코로나 19 예방백신 확보를 위해 각국이 경쟁하고 있으나, 공급량 부족으로 프랑스, 스페인 등에서 접종 일시중단을 발표한 바 있으며, 아스트라제네카는 2021년 1월, EU에 백신 공급량 감축을 통보했습니다.
2021년 2월 24일 기준 국내 승인된 코로나 19 백신 임상시험을 진행하는 곳은 6곳입니다.

각 제품들은 사용하는 플랫폼의 차이로 아데노바이러스 전달체를 사용하는 AdCLD-CoV19와는 차이가 있습니다. DNA 백신의 특징은 저비용으로 대량 생산이 용이하고 안정성이 높아 보관이 편리하지만, 2번 투여를 해야 하고 DNA가 세포 내로 잘 전달되지 않아 상당한 통증을 동반하는 전기천공기라는 투여 장치를 사용해야 한다는 단점이 있습니다.
4월 29일 세계보건기구(WHO)가 발표한 코로나19 백신의 목표 프로파일에서는 최소한 2번 투여 용법, 더 나아가서는 단회 투여 용법을 권장하고 있습니다. AdCLD-CoV19는 단회 근육 투여만으로 코로나19 를 예방할 수 있도록 개발하는 점에서 실제로 투여받는 투여 대상자에게 친화적이고, 편의성이 좋은 장점이 있습니다. 또한, 이러한 차별화된 특성을 바탕으로 향후 신속한 임상시험 진행이 가능할 것으로 기대하고 있습니다.
셀리드는 CeliVax 원천기술을 이용한 BVAC 파이프라인 제품의 개발 및 임상연구를 통해 면역항암치료제를 개발하고 있습니다. CeliVax는 환자 자신의 면역세포를 사용하는 개인 맞춤형 면역치료백신으로 인체 내 모든 면역세포의 기능 및 기전을 활성화시켜 강한 치료작용을 나타내면서 부작용은 최소화된 의약품입니다.
셀리드는 현재의 의학적, 기술적 한계로는 치료가 어려운 난치성 암 및 감염성 질환의 치료에 새로운 패러다임을 제시하는 면역치료백신 개발의 비전을 가지고 설립되었습니다. 면역항암 연구 분야의 탁월한 전문성과 원천기술의 독창성, 유효성, 확장성 및 사업성을 바탕으로 면역치료제 시장의 세계적인 선도 기업으로 거듭나고자 합니다.
셀리드는 아데노바이러스 벡터 기반 예방백신 기술을 보유하고 있으며 이 기술을 활용하여 COVID-19 예방백신을 개발 중이고, 향후 변이 코로나바이러스와 신종 전염병 등에 대한 예방백신 파이프라인을 추가할 계획입니다.
CeliVax 기술을 적용한 주요 파이프라인을 아래 표에 요약하였습니다.
| BVAC-C | 인유두종바이러스 16형 및 18형 암항원을 발현하는 모든 암 (예) 자궁경부암, 두경부암, 항문암, 성기암 등 |
[국내] 자궁경부암 임상 2a상 |
| BVAC-B | HER2/neu 암항원을 발현하는 모든 암 (예) 위암, 유방암 등 |
[국내] 위암 임상 1상 |
| BVAC-P | PAP 또는 PSMA 암항원을 발현하는 모든 암 (예) 전립선암, 뇌종양 등 |
[국내] 전립선암 임상 1상 시험 승인완료 |
| BVAC-M | MAGE-A3 또는 GP100 암항원을 발현하는 모든 암 (예) 흑색종, 폐암, 대장암, 췌장암 등 |
흑색종 비임상 |
| BVAC-Neo | 개인별로 특화된 암항원인 Neo-antigen이 발굴된 모든 암 | 다양한 고형암 비임상 |
임상개발 단계에서 가장 앞선 BVAC-C는 자궁경부암 환자를 대상으로 한 임상 1상에서 의약품으로서의 안전성과 CeliVax 원천기술의 개념을 확증하여 (Proof of Concept: POC) 현재 유효성을 탐색하기 위한 임상 2a상 시험을 진행하고 있습니다. CeliVax 기술의 POC로 다른 BVAC 파이프라인의 개발도 가속화될 예정입니다.
아데노바이러스 벡터 기반 예방백신 플랫폼을 활용하여 COVID-19 예방백신 AdCLD-CoV19의 임상 제1/2a 상 시험계획(IND) 승인을 식품의약품안전처에서 받았으며, 현재 임상 1/2a상 시험을 진행 중입니다.
셀리드 주요 제품

'기업분석 > 제약-바이오' 카테고리의 다른 글
| 지엘팜텍 주가 상승여력 및 배당금, DDS (Drug Delivery System) 기술 개발, 개량 신약 (0) | 2021.07.19 |
|---|---|
| 신라젠 주가전망 및 배당금 - 항암 바이러스 면역치료제/펙사벡(Pexa-Vec) (0) | 2021.07.19 |
| 전진바이오팜 주가전망 및 배당금 - 유해동물 피해감소제 /기생충(Sea Lice) 피해감소제/기생충(닭진드기) 피해감소제 (0) | 2021.07.18 |
| 제이엘케이 주가전망, 의료개혁 시작되나? 인공지능 기반 의료영상 진단 플랫폼 사업/원격 인공지능 헬스케어/인공지능 토털 데이터 매니지먼트 (0) | 2021.07.18 |
| 엔케이맥스 주가전망 및 배당금 - 실험용시약 제조 및 연구개발 (0) | 2021.07.13 |


댓글